添加日期:2017年11月2日 阅读:1750
药品产品专利属于外围专利,其保护强度较化合物专利低,容易被仿制药公司绕开或无效。仿制药公司在ANDA申请时,常采用专利挑战策略二,即专利不侵犯。在专利侵权判定中,等同原则是一项重要原则。作为被告的仿制药企业,经常需要对原研公司所提出的侵权行为进行抗辩。
序言:
“挑战专利不是技术问题,也不是法律问题,它是一种商业策略”。------TEVA CEO 2006
由于制药行业的“专利翘尾价值”,即专利药一般在专利到期前达到销售峰值,仿制药公司的专利挑战显得商业价值极大。不管是TEVA还是Mylan,无不是通过专利挑战而声名鹊起,迅速发展壮大,奠定自己在仿制药江湖的老大地位。专利挑战是任何一家有野心的仿制药公司不可回避的一个商业选择。
仿制药专利挑战背景
1984年《药品价格竞争和专利期修正案》(Hatch-Waxman Amendment)和2003年颁布的《医疗现代化法》(Medicare Modernization Act,MMA),为仿制药申请提供了便捷的路径,即505(j):申请包含信息证明拟申报药物与参比制剂有着完全相同的活性成分、剂型、规格、给药途径、标签信息、质量、特性和适应症等。
505(j)被称为简略新药申请(ANDA),即所谓的仿制药申请,又称“拷贝型”仿制药。Hatch-Waxman法案规格,仿制药公司在提交ANDA申请时,需递交针对RLD在橙皮书上公开登记专利的四种申明之一:
Ⅰ:该新药在橙皮书中无相关专利登记信息;
Ⅱ:该新药在橙皮书中相关药物的专利已经过期;
Ⅲ:在橙皮书中相关药物的专利过期前,不要求FDA批准该仿制药;
Ⅳ:橙皮书中相关药物的专利是无效的,或仿制药的生产、使用、销售不侵犯专利药的专利。
其中,对于第Ⅳ声明,即仿制药公司对原研药品相关专利提出挑战。本文将通过美国仿制药公司典型的专利挑战案例,为国内仿制药公司进行专利挑战提供借鉴。
橙皮书中RLD的专利全景图
FDA橙皮书规定了RLD登记的专利范围,具体如下表所示:

联邦条例314.53规定,新药的专利声明信息根据FDA3542a表与NDA申请同时递交;对于NDA批准后被授权的专利,申请持有人需在30天内通过FDA3542表向FDA进行专利备案。所有通过FDA3542表提交的专利将在FDA橙皮书中相关新药资料中予以公开出版。表FDA3542明确规定了不可列入橙皮书的专利情况,主要包括:

通过分析FDA橙皮书允许登记新药专利范围的限定,FDA橙皮书上登记的专利主要与NDA申报的新药密切相关;不论是活性成分专利还是制剂、用途专利均需要得到NDA申报相关资料数据的支持,否则橙皮书中将不予收录。
仿制药公司的专利挑战典型路径
根据Hatch-Waxman法案,仿制药公司在提交ANDA申请时,仅需对RLD在橙皮书上公开的专利进行声明;仿制药公司进行专利挑战时,也仅需对橙皮书上公开的专利进行挑战,挑战成功即可获批上市并同时获得首仿的180天市场独占。
根据仿制药专利挑战即第Ⅳ声明的定义,仿制药公司的专利挑战主要包括两大策略:1)RLD在橙皮书中登记的相关专利无效;2)仿制药不侵犯RLD在橙皮书中登记的相关专利。针对橙皮书上不同类型的专利,挑战策略如下表所示:
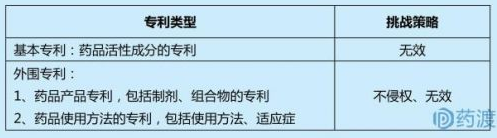
Hatch-Waxman法案规定,通过505(j)途径申请(ANDA)的仿制药应与参比制剂有着完全相同的活性成分、剂型、规格、给药途径、标签信息、质量、特性和适应症等。由于药品的活性成分基本无法规避,所以针对基本专利一般通过专利无效进行挑战;而对于制剂等外围专利的挑战,主要通过不侵权和无效相结合进行专利挑战。Grabowski统计了1994年到2006年高价值专利药的诉讼,并且按照专利分类对诉讼结果进行了统计:

由于化合物专利为强专利,挑战难度较大,可选择化合物专利到期后挑战其他重要的外围专利,从而获得首仿权是大多数仿制药厂商的重要策略。接下来将分别介绍不同专利类型的挑战案例。
药品活性成分的专利挑战
针对橙皮书上登记的药品活性成分专利主要采取专利挑战策略一,即专利无效。美国的专利无效是一个复杂的制度,主要包括行政途径和司法途径。行政途径指的是通过向USPTO提出单方面再审、双方重审和授权后重审。司法途径指的是向法院提出诉讼并由法院进行判定的方式,主要手段包括:1)提起专利权确认诉讼;2)侵权中反诉无效;3)侵权中提起专利权抗辩。两种途径各有优势,在实际应用中,两种途径交叉使用以增加获胜概率。
案例:
背景知识
利奈唑胺( linezolid,商品名:Zyvox)是用于治疗革兰阳性菌感染的药物,FDA于2000年4月18日批准其上市,2014年全球销售额高达14亿美元。原研法玛西亚普强公司(后被辉瑞收购)申请利奈唑胺相关专利30余项,请求保护的主题涉及化合物、制剂、适应证、联合用药和制备方法等。橙皮书中共登记了化合物、制剂和晶型3项重要专利。

专利挑战
原告:辉瑞(原研公司)
被告:TEVA(仿制药公司)
2009年12月,梯瓦向美国FDA提出200mg/100mL利奈唑胺注射剂的ANDA 申请。在提交专利声明时,梯瓦公司提出对化合物专利US5688792(下称792专利)专利无效、不可实施及仿制药申请并不侵犯792专利。通过文献调查,792专利为在先专利申请(WO9323384)的改进创新成果,无论是基于化合物的显而易见性,还是预料不到的技术效果,均存在较大的质疑空间,为挑战792专利的专利权稳定性提供了机会。2012年5月29日,辉瑞与梯瓦就侵权之争达成和解协议:辉瑞对梯瓦的利奈唑胺发放许可,梯瓦承认792专利的有效性。FDA在30个月后批准了梯瓦的利奈唑胺注射制剂,辉瑞将792专利部分许可给了梯瓦,但**于该化合物专利的注射制剂用途,而不允许延及固体片剂,即在专利到期前36个月额外给予梯瓦利胺唑胺注射液仿制药的美国销售权。
药品产品的专利挑战
药品产品专利属于外围专利,其保护强度较化合物专利低,容易被仿制药公司绕开或无效。仿制药公司在ANDA申请时,常采用专利挑战策略二,即专利不侵犯。在专利侵权判定中,等同原则是一项重要原则。作为被告的仿制药企业,经常需要对原研公司所提出的侵权行为进行抗辩。仿制药公司可以通过以下四种准则对侵权诉讼进行抗辩:①全部技术特征准则;②现有技术的限定准则;③禁止反悔准则;④公共贡献准则。
案例:
背景知识
莫西普利是一种血管紧张素转换酶(ACE)抑制剂,原研公司为华纳兰伯特,后**许可给Schwarz公司。盐酸莫西普利(MH)是莫西普利的盐酸盐,是Schwarz的品牌药Univasc中的活性成分。橙皮书中登记了1 项组合物专利。
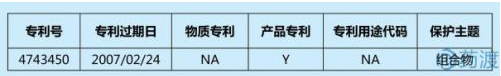
专利4743450(下称450)名称为“稳定的组合物”,于1988年5月10日公告授权。该专利涉及的药物组合物包括:ACE抑制剂盐酸莫西普利和阻止其降解的稳定剂。没有稳定剂,盐酸莫西普利会经环合而降解、因氧化而变色以及水解。专利450提供了一种“使用一种碱金属或碱土金属碳酸盐来抑制环合反应和变色”组合物的方法。
专利挑战
原告:Schwarz公司(原研公司)
被告:Paddock公司(仿制药公司)
2005年,Paddock公司向FDA提交ANDA申请,请求审批仿制药MH和氧化镁(MgO)的片剂上市;同时对橙皮书登记的专利提出PIV挑战,认为仿制药不侵犯原研专利。*初,专利450在权力要求里分别描述了“含稳定剂的金属”和“一种碱金属或碱土金属盐”;但是被审查员拒绝后,该权利要求修改为“一种碱金属或碱土金属的碳酸盐”。Paddock公司提出的不侵权理由即包含MgO不属于450专利里描述的“一种碱金属或碱土金属的碳酸盐”。*终法院认为:权力要求语言改变,缩小了保护范围,除碱金属和碱土金属碳酸盐以外,推定放弃了其他所有的含稳定剂和金属或碱土金属盐的金属;因此,Paddock药物不侵权,根据禁止反悔原则,Schwarz不能要求Paddock使用的MgO作为碱或碱土金属碳酸盐的等同替代。
其实早在1999年,TEVA公司首先对Univasc进行了专利挑战,成功通过规避专利450获得首仿资格;2002年,Ranbaxy提交ANDA并提出PIV挑战,后TEVA和Ranbaxy合作,TEVA放弃其拥有的180天独占期,让Ranbaxy产品顺利获批;Ranbaxy负责生产,TEVA负责营销,从此两仿制药江湖大佬过上了你侬我侬的生活。
药品使用方法的专利挑战
药品使用方法的专利和药品产品专利一样,属于外围专利,其保护强度较化合物专利低,容易被仿制药公司绕开或无效。仿制药公司在ANDA申请时,常采用专利挑战策略二,即专利不侵犯。另外需要注意的是,根据21USC355(j)条款的规定,对于橙皮书中的使用方法专利,仿制药厂商还可以提出“Little VIII Statement”,俗称“小八条声明”,即声明仿制药所申报的适应症不包含于使用方法专利所保护范围内。前提是该药品具有至少两个适应症并且至少一个适应症不受专利保护。小八条声明不涉及专利侵权,故只要符合其它条件,FDA审查完后会立即批准。对于仅含小八条声明的ANDA申请,仿制药厂商并不会获得180天市场独占权。
案例
背景知识
氟西汀是礼来*重要的抗抑郁药品,自1986年Prozac在比利时上市以来,为礼来带来了巨额的利润。礼来为该产品构筑了强大的保护盾牌,在1974-1986年分别申请了多项专利,其中6项获得USPTO的授权。然而,这些专利中难免存在重复和交叉,这就为仿制药公司提供了专利挑战的机会。氟西汀在橙皮书中登记的专利中,有一项专利US626549是关于药品使用方法。
专利挑战
原告:Eli Lilly公司(原研公司)
被告:Barr Labs公司(仿制药公司)
1995年12月,Barr Labs向FDA提交ANDA,同时提交了PIV声明。1996年3月10日,礼来向地区法院提起专利侵权诉讼,诉Barr Labs侵犯礼来US626549专利。Barr Labs辩称专利涉嫌重复专利。该专利挑战的焦点在于早在1994年4月过期的US4590213专利与US626549专利的主张专利是否相同。US626549专利主张之一是通过服用氟西汀可阻止动物脑神经元吸收5-羟色胺,而US4590213专利主张之一是一种治疗人焦虑的方法,能够使服用有效浓度的氟西汀患者治疗焦虑。*终法院认为,US4590213和US626549没有显著差别,是重复专利,礼来败诉。Barr Labs赢得了180天的首仿独占期,基于相对低廉的价格,Barr Labs退出的首仿药在上市的头2个月就占据了Prozac 65%的市场份额。
思考
上文提供了仿制药公司进行专利挑战时可选用的常规战术;但在战略上,仿制药公司应站在更高层次上跨部门、多团队合作,细致缜密进行专利研究、布局和挑战;通过分析对手橙皮书内外的专利布局,提前进行仿制药研究,仿中有创,仿创结合,在提交ANDA申请时形成自己PIV挑战策略,同时申请自己相关专利;这样既能有效挑战原研专利,又能对其他仿制药公司形成专利压制。
Hatch-Waxman法案为仿制药公司提供了有力的两把斧:1)橙皮书制度:强制要求原研药公司公开新药专利,同时限定了能够登记在橙皮书上专利的范围;这样可以有效阻止原研药为延缓仿制药上市而制定的各种专利陷阱和庞大的专利池;2)专利挑战制度:通过ANDA途径申请的“拷贝型”仿制药,仅需针对参比制剂在橙皮书上登记的专利进行挑战,挑战成功即获得180天首仿市场独占,而不需要关心橙皮书以外的专利。Hatch-Waxman法案有效的降低了仿制药公司开发通用版药物的门槛,值得我国监管者借鉴。
文章来源:
1.凡本网注明“来源:1168医药招商网”的所有作品,均为广州金孚互联网科技有限公司-1168医药招商网合法拥有版权或有权使用的作品,未经本网授权不得转载、摘编或利用其它方式使用上述作品。已经本网授权使用作品的,应在授权范围内使用,并注明“来源:1168医药招商网http://www.1168.tv”。违反上述声明者,本网将追究其相关法律责任。
2.本网转载并注明自其它来源(非1168医药招商网)的作品,目的在于传递更多信息,并不代表本网赞同其观点或和对其真实性负责,不承担此类作品侵权行为的直接责任及连带责任。
3.其他媒体、网站或个人从本网转载时,必须保留本网注明的作品第一来源,并自负版权等法律责任。
4.如涉及作品内容、版权等问题,请在作品发表之日起一周内与本网联系,否则视为放弃相关权利。联系邮箱:1753418380@qq.com。

【适用范围】用于缓解颈、肩、腰、腿及闭合性软组织疼痛、肿胀等不适症状人群的物理冷敷。【使用方法】外用。将本品适量直接涂抹于不适部位,轻轻按摩2-3分钟,每日2-3次。

【适用范围】用于缓解颈、肩、腰、腿及闭合性软组织疼痛、肿胀等不适症状人群的物理冷敷。【使用方法】外用。将本品适量直接涂抹于不适部位,轻轻按摩2-3分钟,每日2-3次。
 粤公网安备 44011102000390号
粤公网安备 44011102000390号